Проект "Соединения галогенов, как лекарственных средств"

В индивидуальной исследовательской работе по химии "Соединения галогенов, как лекарственных средств" дается определение понятия "галогены", проводится изучение их строения, соединения, химических и физических свойств, а также выясняется, где применяются галогены, рассказывается о пользе и вреде галогенсодержащих лекарств и некоторых препоратов йода.
Подробнее о проекте:
В процессе работы над исследовательским проектом по химии учащаяся рассмотрела информацию о галогенах и о всём, что с ними связанно, а также выявила последствия попадания галогена внутрь организма, учитывая токсичность этого вещества. В работе указаны химические формулы всех соединений галогенов, а также изучается биологическая роль галогенов и особенности галогеносодержащих лекарственных средств.
Обучающаяся института профессионального образования в рамках своего проекта на тему "Соединения галогенов, как лекарственных средств" выяснила химические свойства галогенов, рассказала, как провести экспресс-анализ на наличие галогенов в лекарственном средстве в условиях аптеки, а также дала описание препаратов галогенидов щелочных металлов и качественный анализ и количественное определение лекарственных форм, содержащих галогениды щелочных металлов.
Оглавление
Введение
1. Галогены и их соединения.
2. Биологическая роль галогенов.
3. Галогенсодержащие лекарственные средства.
4. Химические свойства галогенов.
5. Экспресс- анализ в условиях аптеки.
6 Препараты галогенидов.
7. Описание препаратов галогенидов щелочных металлов и качественный анализ.
8. Количественное определение лекарственных форм, содержащих галогениды щелочных металлов.
9. Результаты выполнения исследования.
Заключение
Список литературы
Введение
Галогены реагирую почти со всеми простыми веществами, кроме некоторых неметаллов. Так как все галогены- это окислители, то они часто встречаются в виде соединений. Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к йоду. Количество астата в земной коре измеряется граммами, а теннессин в природе отсутствует. Фтор, хлор, бром и йод производятся в промышленных масштабах, причём объёмы производства хлора значительно выше, чем трёх других стабильных галогенов.
Так как гологены имеют токсичность, это автоматически делает их ядовитыми веществами, что приводит к удушающим и поражающим ткани воздействиям. Именно поэтому моей целью является рассказать как можно подробно об галогенах, их строениях, соединенях, химических и физических свойствах, а также где применяются галогены, о пользе и вреде галогенсодержащих лекарствах и некоторых препоратах йода.
Исходя из выше поставленной цели, можно сказать, что основными задачами являются исследование и изучение информации о галогенах и о всём, что с ними связанно. Второй задачей является выявление последствий попадания галогена внутрь организма, учитывая токсичность галогена.
Галогены и их соединения
Галоген- это элементы, способные вступать в реакции практически со всеми веществами простого типа за исключением некоторого количества неметаллов. Все они являются энергетическими окислителями, потому в условиях природы, как правило, находятся в смешанной форме с другими веществами.
Галогениды - соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть электроотрицательным.
К данной группе минералов относятся фтористые, хлористые, бромистые и йодистые соединения.
Галогениды составляют около 100 минералов и слагают около 0,5% по весу от земной коры. Наибольшим распространением пользуются фтористые соединения (фториды) и хлористые — хлориды.
Галогениды натрия и калия — типичные ионные соединения. Ионы в кристаллохимической структуре этих галогенидов слабо поляризованы. Все это определяет их физические свойства — прозрачность, стеклянный блеск, небольшие удельный вес и твердость, низкие показатели преломления, легкую растворимость в воде. В галогенидах тяжелых металлов при замене калия и натрия, например, серебром ионные связи меняются на ионно-ко-валентные. То же происходит и при замене хлора на фтор. Благодаря этому меняются физические свойства таких галогенидов: флюорит, например, нерастворим в воде, имеет большие удельный вес и твердость и т. д. Галогениды входят в состав тканей животного и человеческого организма.
Соединения хлора встречаются во всех тканях, остальные в определенных частях: фтор – в костной ткани, особенно в зубах, бром – в железах внутренней секреции, в гипофизе, йод - в щитовидной железе, крови. Недостаток их вызывает заболевания человека. Поэтому их широко применяют в медицине.
Натрия хлорид применяют для приготовления солевых (гипо-, изо-, гипертонических) растворов, плазмозамещающих жидкостей, физиологических растворов.
Калия хлорид источник ионов калия при гипокалиемии, антиаритмическое средство, входит в состав плазмозаменителей.
Натрия бромид, калия бромид – cедативные средства; внутривенно или перорально (микстуры).
Натрия йодид и калия йодид применяют при недостатке йода в организме, воспалительных заболеваниях; входит в состав глазных капель.
Биологическая роль галогенов
Фтор, также как и йод, в организме человека находятся преимущественно в связанном состоянии ( хром и бром – в виде гидратированных ионов) и по своему содержанию ( ~ 7 мл, 10-5 %) относятся к микроэлементам.
Фтор необходим для нормального развития человеческого организма, при его недостатке развивается анемия. Но основная биологическая роль этого элемента связана с его участием в процессах развития зубов, костей и ногтей не только у человека, но и у животных. Он встречается во всех органах человека, но наиболее богатые из них – кости и зубы. В эмали зубов (0,01%) и костных тканях ( его содержание в 100000 раз больше, чем в мягких тканях) фтор находится в минеральной форме , в виде труднорастворимой и кислоустойчивой соли кальция – фторапатите.
Хлор- необходимый и незаменимый для жизни макроэлемент. Его содержание в организме человека превышает 100г.(~ 0,15%) остальные галогены относятся к микроэлементам (10-5 %). В организме он находится в степени окисления -1 в гидратированной форме, как и бромид-ион ( фтор и йод преимущественно в связанном состоянии).
Хлор, в виде растворимых солей натрия, кальция, калия содержится в различных биологических жидкостях и выполняет важную биологическую роль- обеспечивает ионные потоки через клеточные мембраны, участвует в поддержании постоянства осмотического давления крови и других жидкостей (осмотический гомеостаз), участвует в обеспечении необходимой концентрации катионов (химический гомеостаз); активирует некоторые ферменты (пепсин) в процессе выработки желудочного сока и регулировании водного обмена.
Хлороводородная кислота является составной частью желудочного сока человека и животных с W(HCI) от 0,3 до 0,5%.
Хлорид натрия необходим для выработки соляной кислоты в желудочном соке.
Бром содержится в организме человека ~7 мл.,10-5%, что позволяет отнести его к микроэлементам. Он локализуется преимущественно в железах внутренней секреции, в основном в гипофизе- небольшой железе массой всего 0,6.
Бром не уменьшает возбудимость, а усиливает процесс торможения. Препараты брома оказались полезными при нарушении нормального соотношения между процессами возбуждения и торможения в коре головного мозга. В этом и заключается целительное действие бромидов на нервную систему.
Однако механизм действия бромид-ионов окончательно не выяснен. В успокаивающем эффекте, помимо усиления ЦНС, может иметь значение
влияния этих ионов на гипофиз, надпочечники и половые железы. Имеются данные, что соединения брома угнетают функцию щитовидной железы и усиливает активность коры надпочечников. В организм человека бром попадает, главным образом, с пищей растительного происхождения. В растениях бром связан в сложные и большей частью нерастворимые органические соединения. Он всегда есть в растениях, но различные части растений снабжены бромом неодинаково. Больше брома в зеленой части растений, чем в корнях.
Электроотрицательность йода по сравнению с другими галогенами наименьшая. Вследствие этого связь углерода с йодом отличается небольшой полярностью. Этим объясняется возможность образования ковалентной слабо полярной связи йода с углеродом в элементорганических соединениях, в том числе в тироксине. В щитовидной железе эти гормоны синтезируются эпителиальными клетками фолликул. Фолликулы структурно- функциональные единицы щитовидной железы.
Не достаток йода в пище и питьевой воде, а также при недостаточном его всасывании в кровь, приводит к тяжелому заболеванию – эндемическому зобу. Установлено, что заболевание зобом находится в прямой зависимости от содержания йода в воде, почве, воздухе и потребляемой пище.
В начале недостаток йода в организме приводит лишь к небольшому увеличению щитовидной железы, но, прогрессируя, эта болезнь поражает многие системы организма.
Прежде всего, снижается активность щитовидной железы (гипотиреоз); наблюдается нарушение в обмене веществ, замедляется и ослабляется сердечная деятельность, понижается артериальное давление, возникает общая слабость и апатия. Вместе с этим происходит уменьшение «сгорания» жиров, увеличивается содержание холестерина в крови и развивается отек соединительной ткани, наблюдается шелушение кожи и выпадение волос.
Наибольшее распространение эта болезнь получила в горных районов и местностях сильно удаленных от моря. Болезнь может возникнуть в любом возрасте. В раннем она затрудняет и нормальный рост, наблюдается отставание физиологического и психического развития (кретинизм). В зрелом возрасте болезнь ускоряет наступление атеросклероза и старости.
Галогенсодержащие лекарственные средства
При контакте с патогенными микроорганизмами выделяют свободный йод или хлор, которые присоединяются к белкам микроорганизмов и вызывают их денатурацию
Хлоргексидин (Пливасепт) – препараты хлора из группы галогенсодержащих средств. Одно из наиболее активных местных АС. Оказывает быстрое и сильное бактерицидное действием на грамположительные и грамотрицательные бактерии. Эффективен в отношении возбудителей венерических болезней: трепонем, гонококков, трихомонад. Не действует на вирусы и споры. Сохраняет активность в присутствии крови и гноя. Не раздражает кожу и слизистые оболочки.
Применение:
- обработка рук и операционного поля;
- стерилизация хирургического инструментария;
- при гнойно- воспалительных процессах ( промывание ран, ожогов, мочевого пузыря, полости рта и др.)
- индивидуальная профилактика венерических заболеваний (сифилис, гонорея, трихомониаз).
Препараты йода:
Раствор йода спиртовой 5%
Особенности: всасывается с места нанесения; оказывает сильное раздражающее действие- может вызывать ожог, замедляет заживление ран; в концентрации 10% оказывает противогрибковое действие.
Применение: обработка рук хирург, краев ран, операционного поля.
Йодонат- комплекс йода и калия йодида, жидкость темно-коричневого цвета со слабым запахом йода. Не раздражает ткани, не всасывается.
Применение: обработка операционного поля как заменитель раствора йода спиртового.
Йодинол- комплекс йода с поливиниловым спиртом, жидкость темно-синего цвета с запахом йода, пенится при взбалтывании. Имеется длительной действие.
Применение: в лор- практике (хронический тонзиллит, гнойный отит, атрофический ринит); трофические язвы, гнойные раны, ожоги.
Раствор Люголя с глицерином применятся для смазывания слизистой оболочки рта и гортани при воспалительных процессах.
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от флора к теннессину.
Фтор- самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты. Без нагревания фтор реагирует и со многими неметаллами (H, S, С, Si, P); все реакции при этом сильно экзотермические и могут протекать со взрывом.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше ,чем у фтора. Он непостредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без оснащения хлор практически не реагирует с водородом , тогда как и при нагревании или при оснащении( например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами , а также хлор способен при нагревании вытеснять бром или йод из их соединений с водородом или металлами. Обратимо реагирует с водой, образуя равновесную смесь веществ, называемую хлорной водой.
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем ,что бром обычно используют в жидком состоянии, и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Он вступает в те же реакции, что и хлор. Являясь более мягким реагентом, бром находит широкое применение в органической химии.
Бром, так же как и хлор растворяется в воде и, частично реагируя с ней, образует так называется «бромную воду».
Растворимость в воде йода – 0,3395 грамма на литр при 25 градусах Цельсия, это меньше, чем у брома. Водный раствор йода называется «йодной водой». Йод способен растворяться в растворах йодидов с образованием комплексных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же йода с водородом происходит только при сильном нагревании, реакция является эндотермической и обратимой.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду с F-At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенидион любого из последующих галогенов .
Экспресс- анализ в условиях аптеки
Экспресс-анализ совокупность методов и приемов количественного химического анализа, с помощью которых можно быстро производить текущий контроль производимой продукции.
Качественный экспресс-анализ проводят на фильтрованной бумаге, предметном или часовых стеклах, на фарфоровой лодочке или в тигле, про этом расход анализируемого вещества составляет от 0,001 до 0,01г. или от 1 до 5 капель жидкости.
На фильтровальной бумаге проводят реакции, в результате которых образуется окрашенные соединения, если при этом не требуется применение концентрированных кислот или оснований. Для выполнения реакций, исследуемое вещество набирают пипеткой с оттянутым концом и прикасаются им к фильтровальной бумаге. Тем же методом наносят реактив в центре полученного пятна или рядом с ним. В месте контакта реагирующих веществ образуется ожидаемое окрашивание.
Реакции, в результате которых образуются осадки белого цвета, выполняют на часовых или предметных стеклах, помещенных на темную поверхность. Реакции с концентрированными кислотами или основаниями проводят на фарфоровых чашках.
Реакция, протекающие с выделением газообразных веществ, проводят с использованием реактивных бумажек (пропитанных ацетатом свинца, реактивом Несслера и др.)
Анализ неорганических лекарственных средств сводится к идентификации катионов и анионов. При анализе органических лекарственных средств используют анализ по функциональным группам, а так же как групповые, так и специфические реакции.
Количественный экспресс анализ в условиях аптеки предусматривает определение содержания ингредиентов в лекарствах титриметрическими и физико-химическими методами.
Титриметрический экспресс методы анализа имеют следующие особенности:
- используются титрованные растворы различных концентраций : 0,1; 0,5; 0,02; 0,01моль/г
- навески жидких препаратов для титрования (1-3мл) берут пипетками, навески порошков- на ручных аптечных весах (0,05-0,1 г). Навеску берут таким образом, чтобы на титрование расходовалась 1-3 мл титрованного раствора.
- Для титрования используют микробюретки с делениями 0,02 мл или пипетки на 2,5 или 10 мл с делениями 0,05 мл.
- Титрование проводят в склянках на 10-20 мл.
Препараты галогенидов
По физическим свойства соли галогенводородных кислот имеют много общего. Все это, как правило, белые кристаллические вещества, имеющие различную кристаллическую решетку и форму кристаллов. Имеют горько-соленый вкус. Растворимы в воде, причем хлориды менее, чем йодиды.
Методы получения. Хлорид натрия получают из соляных копей (каменная соль- смесь хлорида натрия и калия с примесью хлоридов щелочноземельных металлов и бромидов) и выпариванием воды и соляных озер. Очистку до фармакопейного хлористого натрия проводят перекристаллизацией и выпариванием из кислого раствора поваренной соли.
Хлорид калия получают одновременно с хлоридом натрия из каменной соли- сильвинит, хлорид калия выделяют методом флотации.
Бромиды и йодиды получают обычно из соответствующих солей железа. Методы очистки одинаковы- перекристаллизация из воды с добавлением соответствующих галогенводородных кислот, что снижает растворимость солей в воде.
Описание препаратов галогенидов щелочных металлов и качественный анализ
Из этой группы фармакопейными препаратами является: натрия хлорид (NaCI) , калия хлорид (KCI), натрия бромид (NaBr), калия бромид (KBr), Натрия йодид (NaJ), калия йодид (KJ). Все эти препараты являются фармакопейные и имеют много общего в способах получения и свойствах, методах анализах, но действие их на организм различно.
Natriichloridum
Натрияхлорид
Натрий хлористый. Поваренная соль.
NaClМ.м. 58,45
Свойства. Белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в 3ч. воды.
Испытание на подлинность. 1) Раствор препарата (1:100) подкисляют несколькими каплями разведенной азотной кислоты и прибавляют 0,5 мл раствора нитрата серебра. Образуется белый творожистый осадок, легко растворимый в растворе аммиака.
2) Крупинка препарата, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Хранение. В хорошо закуренных банках, в сухом месте.
Применение. Натрия хлорид является основной частью солевых и коллоидно-солевых растворов, применяющихся в качестве плазмо-заменяющих жидкостей. Натрия хлорид содержится в крови и тканевых жидкостях организма (концентрация в крови 0,5%). Основная роль его- обеспечить постоянство осмотического давления крови. При дефиците натрия хлорида в организм вводят в/в или п/к 0,9% раствор (изотонический раствор). В большом количестве (500 мл и больше ) вводят при больших потерях крови, явлениях диспепсии. 0,9% раствор применяется в качестве растворителя различных лекарственных препаратов. Применяют также 3%, 5%, 10% растворы - гипертонические: наружно для компрессов, примочек, при лечении гнойных ран (отделения гноя) иногда в/в 10% (10-20 мл) медленно при легочных, желудочных и кишечных кровотечениях, для усиления диуреза. Натрия хлорид используют также для ванн, обтираний, полосканий при заболевании верхних дыхательных путей, как противоядие при отравлении AgNO3.
Формы выпуска: порошок, таблетки 0,9, р-ры для инъекций 0,9% в ампулах, флаконах- в/в 10% р-р, Комбинированные; спрей «Салин», р-рыРингера, Рингера-Локка, Трисоль, Дисоль.
- Kaliichloridum
- Калия хлорид
- Kaliumchloratum
- KCIМ.м. 74,56
Свойства. Белый кристаллический порошок или бесцветные кристаллы без запаха, соленого вкуса. Растворим в 3-х частях холодной воды и практически не растворим в 95% спирте. Растворы нейтральной реакции.
Испытание на подлинность. На хлорид ион: добавляют раствор нитрата серебра, выпадает белый творожистый осадок.
На К+-ион: 1) по окрашиванию пламени горелки в фиолетовый цвет, а если смотреть на пламя через синее стекло, то оно кажется окрашенным в пурпурно-красный цвет.
2) c виннокаменной кислотой в присутствии ацетата натрия (можно с солью гидротартратом натрия- сегнетова соль) осадок белого цвета. Осаждению способствует охлаждение смеси, встряхивание и потирание стеклянной палочкой о стенки пробирки.
3) с раствором гексанитрокобальтата (III) натрия выпадает жёлтый осадок, реакцию проводят в уксуснокислой среде при потирании палочкой о стенки пробирки.
Хранение: в условиях предупреждающих окисление: сухое место, закупоренные банки.
Применение. При нарушении сердечного ритма (антиаритмическое), особенно в связи с интоксикацией сердечными гликозидами, когда происходит обеднение клеток миокарда ионами калия , улучшает сокращение мышц- дистрофия, миостения. - в случае гипокалиемии (снижение калия в организме), которая происходит при длительном приёме диуретических средств.
Форма выпуска: порошок, таблетки по 0,5 и 1,0, таблетки «Панангин», «Аспаркам», шипучие таблетки К-Лайт, пролонгированные таблетки К-Дур. Калий-норм, Калипоз. Назначают внутрь в виде 10% водного раствора, при тяжёлой интоксикации в/в 4% р-р.
- Natrium bromatum
- Natriibromidum
- Натриябромид
- Натрий бромистый
- NaBrМ.м. 102,91
Свойства. Белый кристаллический порошок без запаха ,соленого вкуса. Растворим в 1,5 ч. воды и в 10 ч. спирта. Гигроскопичен.
Испытание на подлинность. 1) К 10 мл раствора препарата (1:10) прибавляют 2 мл разведенной соленой кислоты 0,5 мл хлорной воды или раствора хлорамина,1мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.
2) Крупинка препарата, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Хранение. В хорошо закупоренных стеклянных банках, в сухом защищенном от света месте.
Применение. Успокаивающее, седативное средство. Действие основано на способности его усиливать процессы торможения в коре большого мозга, применяют при неврастении, повышенной раздражительности, бессоннице, эпилепсии. Доза для взрослых 0,5г внутрь.
Формы выпуска:порошок, таблетки по 0,5 , микстуры 3% ( Павлова, с адонисом). Водный р-р с фруктовым сиропом 1%,2%, 3%. Р-р натрия бромида и калия бромида с фруктовым сиропом 1%,2%, 3%.
- Kaliumbromatum
- Kaliibromidum
- Kалия бромид
- Калий бромистый
- KBrМ.м.119,02
Свойства. Бесцветные или белые блестящие кристаллы или мелкокристаллический порошок без запаха, сильно соленого вкуса. Растворим в 1,7 ч. воды, мало растворим в спирте. На воздухе устойчив.
Испытание на подлинность. К 10 мл раствора препарата (1:10) прибавляют 2 мл разведенной соляной кислоты ,0,5 мл раствора хлорамина или хлорной воды, 1мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-бурый цвет.
К 2 мл такого же раствора прибавляют 2 мл разведенной уксусной кислоты и 2 мл раствора виннокаменной кислоты. Выпадает белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких щелочей.
Хранение. В хорошо закупоренных стеклянных банках, в сухом, защищенном от света месте.
Применение. Как натрия бромид доза 0,3-0,5 г на приём Выпуск: пилюли и таблетки по 0,5, порошки, мази 1-2% для кожи. Р-р натрия бромида и калия бромида с фруктовым сиропом 1%,2%, 3%.
- Natriiiodadum
- Натрия йодид
- NaJМ.м. 149,90
Свойства. Белый кристаллический порошок без запаха, соленого вкуса. Растворим в 0,6 ч. воды, в 3 ч. спирта и 2 ч.глицерина. На воздухе сыреет.
Испытание на подлинность. 1)К 10 мл раствора препарата (1:20) прибавляют несколько капель раствора хлорида окисного железа, 2 капли соляной кислоты и 2мл хлороформа. Хлороформный слой окрашивается в фиолетовый цвет.
2) Крупинка препарата, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Хранение. В хорошо закупоренных банках оранжевого стекла, в сухом месте.
Применение. Источник микроэлемента. Антитириоидное. Применяют как препараты йода, при гипотиреозе (мало йода в пище, воде), эндемическом зобе- болезни щитовидной железы. Если пища или вода не содержит достаточного количества йода, то возникает кретинизм (зобная болезнь). При воспалительных заболеваниях дыхательных путей, астме. Назначают в виде микстур.
Формы выпуска: порошок, микстуры 3%, р-р 10% в/в.
- Kaliumiodatum
- Kaliiiodatum
- Калия йодид
- Калий йодистый
- KJМ.м.166,01
Свойства. Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса .
Растворим в 0,75 ч. воды, в 12 ч. спирта и в 2,5 ч глицерина. Стойкий в сухом воздухе, сыреющий во влажном.
Испытание на подлинность. 1) К 10 мл раствора препарата (1:20) прибавляют несколько капель раствора хлорида окисного железа 2 капли соляной кислоты,2 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в фиолетовый цвет.
2) к 2мл раствора препарата (1:10) прибавляют 2 мл разведенной уксусной кислоты и 2мл раствора виннокаменной кислоты. Выпадает белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких щелочей.
Хранение. В хорошо закупоренных банках оранжевого стекла.
Применение. Как препарат йода при эндемическом зобе. Противомикробное (катаракта, коньюктивит, воспаление роговицы, травмы). Применяют в пилюлях, растворах микстурах по 0,3-0,5г на 1 приём. Препарат прописывают вместе с NaHCO3 (чтобы не было раздражения слизистой).
Формы выпуска: порошок, таб. 0,04, 0,10, 0,125, 0,2, 0,5,1,0; р-р 3% внутрь, таб. «Йодтирокс», глазные капли 3%.
Количественное определение лекарственных форм, содержащих галогениды щелочных металлов
Аргентометрический метод (аргентометрия)
Основан на свойстве галогенидов количественно осаждаться серебра нитратом с образованием малорастворимых галогенидов серебра.
Варианты:
а) метод Мора. Метод прямого титрования хлоридов или бромидов нитратом серебра в нейтральной или слабощелочной среде. Индикатор - хромат калия.
ГФ X предлагает использовать этот вариант для количественного определения следующих лекарственных веществ: натрия хлорид (NaCl); калия хлорид (КС1); натрия бромид (NaBr); калия бромид (KBr).
1) NaCl + AgNO3 → AgCl↓ + NaNO3
2AgNO3 + K2CrO4→ Ag2Cr04↓ + 2 KNO3
2) KCl + AgNO3 → AgCl↓ + KNO3
2AgNO3 + K2CrO4→ Ag2Cr04↓ + 2 KNO3
3) NaBr + AgNO3→ AgBr↓ + NaNO3 fэкв = 1
2AgNO3 + K2CrO4→ Ag2Cr04↓ + 2 KNO3
4) KBr + AgNO3 → AgBr↓ + KNO3
2AgNO3 + K2CrO4→ Ag2Cr04↓ + 2 KNO3
При одной избыточной капле титранта образуется оранжево-желтый осадок. В кислой среде понижается чувствительность индикатора, за счет растворимости осадка хромата серебра, а в сильно щелочной разрушается титрант с образованием оксида серебра. Метод нельзя применять для определения йодидов, так как йодид серебра в нейтральной среде адсорбирует на поверхности йодид-ионы.
б) метод Фаянса. Метод прямого титрования нитратом серебра в слабокислой среде в присутствии адсорбционных индикаторов. Адсорбционные индикаторы являются солями слабых кислот и обладают способностью адсорбироваться на частицах осадка. При титровании нитратом серебра образуется осадок галогенида серебра, который адсорбирует галогениды, находящиеся в избытке. В точке эквивалентности, когда все галогениды будут связаны, частицы теряют заряд. Наблюдается коагуляция при введении незначительного избытка нитрата серебра, частицы заряжаются положительно и притягивают анион индикатора, осадок приобретает соответствующее окрашивание. Метод Фаянса является фармакопейным для йодидов натрия и калия.
Титрование проводят в уксусной среде, индикатор - эозинат натрия, титруют до розового окрашивания осадка. Этот индикатор можно использовать для количественного определения йодидов. Определение бромидов и хлоридов проводят в присутствии индикатора бромфенолового синего в уксуснокислой среде. В точке эквивалентности наблюдается переход окраски от зеленовато-желтой до фиолетовой. Эозинат натрия не используется для количественного определения хлоридов, так как анион эозина в самом начале титрования вытесняет хлориды из осадка и розовая окраска наступает от первой капли титрованного раствора.
в) метод Фольгарда. Вариант обратного титрования с использованием двух титрованных растворов - серебра нитрата и аммония тиоцианата.
Определение проводят в азотнокислой среде во избежание гидролиза индикатора, индикатор - железо-аммониевые квасцы. Метод используется для определения бромидов, йодидов, реже хлоридов, входящих в состав лекарственных форм. К раствору галогенида добавляют титрованный раствор серебра нитрата, избыток которого оттитровывают раствором аммония тиоцианата в присутствии железо-аммониевых квасцов до розового окрашивания.
KI + AgNO3(изб)→AgI↓+ KNO3
AgNO3 + NH4SCN→AgSCN↓+NH4NO3
Индикатор – FeNH4(SO4)2 • 12Н2О-железо-аммониевые квасцы.
Fe(III) + 3NH4SCN → Fe(SCN)3 + 3NH4
Роданометрический метод (метод Фольгарда) объемного анализа основан на применении в качестве осадителя титрованного раствора, содержащего:
в качестве стандартных растворов используют: для определения — роданид аммония; для определения галогенидов и других анионов — нитрат серебра и роданид аммония.
Роданометрическим методом пользуются для определения галоген-ионов и серебра в серебряных сплавах.
В роданометрии в качестве индикатора для определения точки эквивалентности применяют насыщенный раствор железо-аммонийных квасцов.
AgCl + NH4SCN → AgSCN↓ + NH4Cl
Анализ опроса по теме «Галогены»
В процессе работы было проведено анкетирование студентов 1 курса . Всего опрошено 50 человек. Вопросы анкеты и результаты представлены в
1. Что такое галогены?
а) да
б) нет
в) не знаю
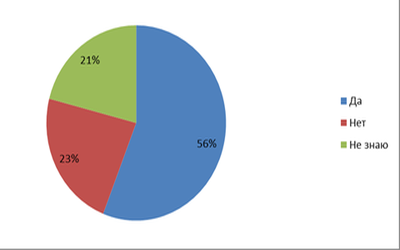
Из 100% респодентов: 56% говорят, что знают о галогенах; 23% не знают их; 21% говорят, что не знают.
2. Вы знаете из чего они состоят?
а) да
б) нет
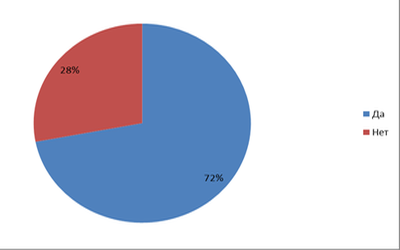
72% респондентов говорят, что они знают ,из чего состоят галогены, а 28% нет.
3. Как вы думаете, как действуют галогены на организм?
а) да
б) нет
в) затрудняюсь ответить
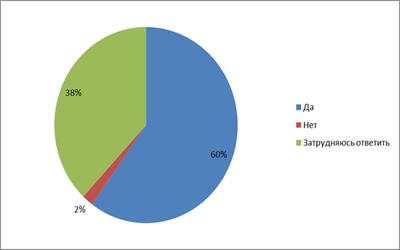
60% студентов утверждают, что галогены не вредны для здоровья, 2% не согласны с этим, а 38% затрудняются ответить.
4. Наиболее ярко выражены окислительные свойства у:
а) брома
б) хлора
в) фтора
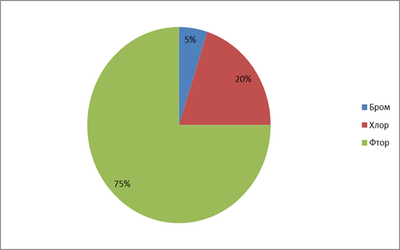
75% студентов утверждают, что это фтор, 20% хлор, а 5% бром.
Заключение
Роль галогенов в организме человека заключается в их уникальном свойстве поддерживать важные химико-биологические обменные процессы (все процессы жизнедеятельности человека).
Фтор содержится во всех человеческих органах и играет важную роль в строении костей, зубов.
Бром содержится в почках, печени, крови, мозге.
Йод важен для функционирования щитовидной железы.
Хлор помогает поддерживать в организме осмотическое давление лимфы и крови, сохраняет баланс воды.
Как мы видим, галогены являются очень важной частью периодической таблицы Менделеева, они имеют множество свойств, отличаются между собой по физическим и химическим качествам, атомному строению, степени окисления и способности реагировать с металлами и неметаллами.
Все лекарственные формы приготовлены удовлетворительно, являются доброкачественными, так как фактические отклонения содержания лекарственных веществ в лекарственных формах укладывается в нормы допустимых отклонений (НДО), расчеты которых я производила по Приказу №305 от 16.10.97 «О нормах отклонений, допустимых при приготовлении лекарственных средств и фасовке промышленной продукции в аптеках».
Следовательно при изготовлении лекарственных форм соблюдался санитарный режим (Приказ № 309 от 21.10.1997 «Об утверждении инструкции по санитарному режиму аптечных организаций»), не нарушалась технология изготовления лекарственных форм в аптеке, техника выполнения экспресс-анализа лекарственных форм, у стерильных инъекционных растворов - соблюдался режим стерилизации, что предотвратило разрушение вещества при стерилизации.
При анализе лекарственных форм я проводила качественные реакции основанные на осаждении, разложения, окислении, образовании газообразных и окрашенных соединений.
При проведении количественного анализа я применяла методы осадительного титрования - аргентометрию - методы Мора и Фаянса, которые отличаются средой, в которой проводят определение, применяемыми индикаторами и фиксированием точкой эквивалентности. Также я сочетала аргентометрию с другими методами титрования – комплексонометрией и кислотно-основным титрованием.
При анализе некоторых лекарственных форм я суммарно титровала компоненты прописи и по разности объемов находила содержание лекарственного вещества.
Согласно Приказу №214 от 16.07.97 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях» я провела обязательно следующие виды контроля: органолептический, письменный, контроль при отпуске. Физический контроль обязательно был проведен у прописей - 0,9% изотонический раствор натрия хлорид, 3% раствор калия йодида, у остальных прописей – выборочно (расчеты физического контроля проводила по Приказу №305 от 16.10.97 «О нормах отклонений, допустимых при приготовлении лекарственных средств и фасовке промышленной продукции в аптеках»).
При проведении качественных реакций и количественных определений я соблюдала все условия, производила необходимые расчеты, составляла методики анализа и проводила его.
Список литературы
- Беликов В.Г. Фармацевтическая химия: учеб. пособие / В.Г. Беликов.-4-е изд.,перераб. И доп. – М.: МЕДпресс-информ,2007. С. 141-148
- Фармацевтическая химия: учеб. пособие для студентов, обучающихся по специальности Фармация / под. ред. А.П.Арзаасцева. -2-е изд.,испр.- М.: ГЭОТАР- Медиа, 2006.- С. 40-50.
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений. М.: Дрофа, 2008.
