Проект "Фосфор в окружающей среде"

Детская исследовательская работа по химии "Фосфор в окружающей среде" рассматривает историю открытия и изучения фосфора, а также получения им именно такого названия. Учащийся 11 класса обращается к справочной литературе по теме и выясняет, какие виды фосфора существуют.
Подробнее о проекте:
В процессе работы над исследовательским проектом по химии об исследовании свойств и особенностей фосфора учащийся школы рассмотрел, как происходит получение фосфора, а также подробно описал, какими физическими и химическими свойствами обладает данный элемент периодической таблицы Менделеева, дал определение черного, белого, желтого и красного фосфора.
Учащийся 11 класса школы в рамках своего проекта по химии на тему "Фосфор в окружающей среде" описал, какие соединения фосфора встречаются и какова их биологическая роль. Также в работе рассказывается о соединении фосфора в окружающей среде и его содержании в привычных нам продуктах питания. Со списком продуктов можно ознакомиться в приложении к проекту.
Оглавление
Введение
1. История фосфора.
2. Происхождение названия.
3. Получение фосфора.
4. Физические свойства фосфора.
5. Химические свойства фосфора.
6. Соединения фосфора.
7. Применение фосфора.
8. Биологическая роль соединений фосфора.
9. Соединения фосфора в окружающей среде.
Заключение
Литература
Приложения
Введение
Идея, сподвигнувшая меня создать этот проект, появилась, когда мы изучали на уроке химии свойства фосфора. Я принял решение поделиться полученными знаниями со сверстниками и расширить их познания в этой области.
Фо́сфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15.
Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит ( Сa3(PO4)2 ). Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Цель работы: подробно изучить происхождение, историю открытия, свойства и области применения фосфора и его соединений.
Узнать:
- Какова история фосфора?
- Какие свойства имеет фосфор и его соединения?
- Как добывают фосфор в промышленности?
- Чем опасен и полезен фосфор?
Задачи:
- изучить литературные источники по данной теме;
- выяснить особенности свойств фосфора и его важнейших соединений;
- обобщить материал в исследовательской работе.
История фосфора
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи.
Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте.
Бранд назвал это вещество phosphorusmirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности. Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Изотопы. Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30P (T1/2 = 2,5 мин), 32P (T1/2 = 14,26 сут) и 33P (T1/2 = 25,34 сут).
Происхождение названия
В 1669 году ХеннингБранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φώς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение фосфора
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Ca3(PO4)2 + 5C + 3SiO2--> 2P + 5CO + 3CaSiO3
{\displaystyle {\mathsf {2Ca_{3}(PO_{4})_{2}+10C+6SiO_{2}\rightarrow P_{4}+10CO+6CaSiO_{3}}}} 2Ca3(PO4)2 + 10C + 6SiO2 --> P4 + 10CO + 6CaSiO3
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, метафосфорную кислоту:
Фосфорный ангидрид, смешанный в надлежащей форме с углем и нагретый до светлокрасного каления, вполне восстановляется им с образованием оксида углерода (II):
Физические свойства фосфора
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор.
Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента.
Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легко растворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный (Приложение 2).
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтым фосфором». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется.
Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по Цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды или раствора хлорида кальция.
Красный фосфор
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость.
Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа).
Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции.
Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅106 Па.
Металлический фосфор
При 8,3⋅1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25⋅1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства фосфора
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4 P + 3 O2 = 2 P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина;
с неметаллами — восстановитель:
2P + 5Cl2 → 2PCl5
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3.
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода протекает при температуре 700-900 °C. Катализатором могут выступать: платина, медь, титан, цирконий:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства фосфора
Сильные окислители превращают фосфор в фосфорную кислоту:
2P + 5H2SO = 2H3PO4+5SO2+H2O
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Соединения фосфора
Рассмотрим свойства основных соединений фосфора, в которых он проявляет степень окисления +5. Оксид фосфора (V) – это белый порошок, расплывающийся на воздухе вследствие поглощения паров воды. Поэтому его используют для очистки органических соединений от следов воды.
При растворении в воде оксида фосфора (V) образуется фосфорная кислота. При этом сначала образуется метафосфорная кислота, после кипячения смеси – ортофосфорная:
HPO3 + H2O = H3PO4
Ортофосфорная кислота представляет собой белое кристаллическое вещество. В воде она ступенчато диссоциирует:
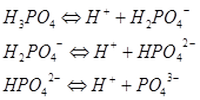
В зависимости от числа атомов водорода, которые нейтрализуются щелочью, ортофосфорная кислота может образовать три вида солей: дигидрофосфаты (например, дигидрофосфат натрия NaH2PO4), гидрофосфаты (например, гидрофосфат калия K2HPO4) и ортофосфаты (например, фосфат кальция Ca3(PO4)2).
Фосфорная кислота является кислотой средней силы, и для нее характерны все общие свойства кислот. Слабые растворы ортофосфорной кислоты добавляют в различные напитки.
Фосфорная кислота является сырьем для производства минеральных удобрений: фосфорных и комплексных. Примером фосфорного удобрения может служить двойной суперфосфат Са(Н2РО4)2. А одним из комплексных удобрений является аммофоска – содержит необходимые растению азот, фосфор и калий.
Применение фосфора
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор. Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве. Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски.
Соединения фосфора в промышленности. Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии)
Фосфатные связующие. Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок в строительстве и художественном литье.
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)2 Ca(OH)2.
В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приеме фосфора вместе с кальцием в соотношении 3 : 2.
Токсикология элементарного фосфора
Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы.
При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³. Фосфор относится к 1-му классу опасности.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой (15 мг/кг) токсичности большинство фосфорорганических соединений (ФОС) используются в качестве пестицидов (инсектициды, акарициды, зооциды) или боевых отравляющих веществ. Примером боевых отравляющих веществ являются — зарин, зоман, табун, новичок, V-газы.
ФОС проявляют свойства веществ нервнопаралитического действия. Токсичность фосфорорганических соединений обусловлена ингибированием фермента ацетилхолинэстеразы, вследствие чего развивается головная боль, тошнота, головокружение, сужение зрачков (миоз), затруднение дыхания (одышка), возникает слюнотечение, понижается артериальное давление, возникают конвульсии, проявляется паралитическое воздействие, кома, и как следствие может быстро возникнуть летальный исход. Эффективным антидотом при отравлении ФОС является атропин.
Соединения фосфора в окружающей среде
Фосфор хотя и не является главным элементом в земной коре (его кларк около 0,1%), однако играет важную роль в экосфере. Это связано с тем, что без него невозможен синтез белков. Наряду с углеродом, кислородом, водородом, азотом и серой фосфор является элементом, необходимым для существования живого вещества, и одновременно условием, часто определяющим его биомассу и продуктивность.
Среднюю концентрацию элемента в сухом веществе растительности суши можно принять равной 0,2%, в биомассе океана значительно выше – 1,1%. В живом веществе суши находится 5×109 т фосфора, океана – всего 0,077×109 т. Значительная часть элемента сохраняется в мертвом органическом веществе, в котором концентрация фосфора составляет около 0,15%. Так как на суше количество органических остатков торфа и гумуса меньше массы дисперсного органического вещества в океане, то в этой форме фосфора на суше несколько меньше (4,2×109 т), чем в океане (6×109 т).
Характерная особенность глобального цикла фосфора – отсутствие постоянно действующего геохимического потока, возвращающего крупные массы элемента на сушу. Перенос его через атмосферу в форме аэрозолей незначительный и не может компенсировать вынос элемента в водном стоке с суши в океан. Медленное, но не прекращающееся осаждение в океане неуклонно выводит его из миграционных циклов низшего ранга. Глобальный цикл фосфора является наименее замкнутым по сравнению со всеми другими элементами.
Единственный источник поступления элемента в глобальный цикл – выветривающиеся горные породы суши. Фосфор присутствует в почвообразующих породах, главным образом, в виде нерастворимого в воде минерала апатита. Но он хорошо растворим в неорганических кислотах, например азотной кислоте. Взаимодействие азотной кислоты с апатитом дает воднорастворимые соединения фосфора, доступные для питания растений. Азотная кислота поступает в почву во время летних гроз, что в основном и обеспечивает растения азотным питанием, однако в большинстве мест на поверхности Земли ее недостаточно для обеспечения высоких урожаев.
Деятельность человека в настоящее время направлена на увеличение содержания фосфора в окружающей среде. Это явление В.А. Ковда назвал фосфатизацией суши. Она происходит, главным образом, в результате извлечения фосфора из агроруд для производства фосфорных удобрений, различных фосфорсодержащих препаратов. Производимые в настоящее время удобрения содержат (18—20)×106 т фосфора, а добываемые морские продукты – половину этого количества.
Несмотря на общую тенденцию фосфатизации суши, запасы фосфора в почвах остаются малыми – в среднем 0,1-0,2%, из них от 20 до 40% практически недоступные растениям. Поэтому фосфора для земледелия не хватает и потребление его будет расти. Только одна химическая промышленность производит ежегодно 18-20 млн т фосфорных удобрений.
В связи с ростом масштабов применения фосфорсодержащих удобрений возникает проблема загрязнения окружающей среды фтором, входящим в состав фосфатного сырья. Фтор обладает высокой химической активностью и представляет опасность для здоровья людей и животных. Избыточное накопление фтора в кормах может стать причиной заболевания животных флюорозом, симптомы которого включают дефекты зубов, поражение суставов, ломкость костей, хромоту. Животные теряют аппетит, худеют, снижается их молочная и мясная продуктивность.
Фосфорное сырье содержит еще несколько сопутствующих элементов, среди которых есть вещества, обладающие высокой токсичностью и опасным накоплением в организме человека и животных. К ним относятся свинец и кадмий. Хотя непосредственной опасности широкого загрязнения среды кадмием и свинцом из фосфорного сырья пока нет, но потенциальная все же существует.
Согласно американским исследованиям, человеку попадает 1/10 часть фосфора, затраченного на выращивание кормов для скота. Из этого количества 3/10 остаются и фиксируются почвами, а 6/10 поступают со стоками в водоемы. Последние накапливают фосфор и становятся токсичными, если содержание фосфора в них превышает 15 мг/л (чистые воды должны содержать фосфора не более 0,01-0,009 мг/л). Наряду с этим, отмечается все больший геохимический сток фосфора в реки, озера, моря и океаны. Подсчитано, что около 3-4 т фосфатов ежегодно выносится речными стоками.
Заключение
Итак, я провел планируемое исследование и узнал много нового. Над своим исследованием я трудился очень увлеченно, мне было интересно узнать, каковы состав и строение соединений фосфора, что придает им полезные свойства.
В перспективе мне хотелось бы обратиться к медицинскому аспекту данной темы, узнать, как именно влияет фосфор на органы и ткани человеческого организма.
При подготовке работы и презентации к ней, я подробно ознакомился с требованиями к оформлению исследовательских работ, что обязательно пригодится мне в дальнейшей учебной деятельности в школе и в вузе. Свойства фосфора и его соединений, изученные в работе, помогут мне правильно и безопасно применять их в жизни.
Считаю, что цель моей работы достигнута.
Литература
- Лидин Р.А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000.
- Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990.
- Редкол.: Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999.
- В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др. Химия = Chemie. — М.: Химия, 1989.
- Интернет-источники.
Приложение 1

Приложение 2. Содержание фосфора в продуктах питания
| Продукт | Содержание, мг/100 г |
| Очищенное конопляное семя | 1650 |
| Семена тыквы (ядра) | 1233 |
| Семена подсолнечника (ядра) поджаренные | 1158 |
| Семена мака | 870 |
| Горчичный порошок | 828 |
| Кунжут (очищенный) | 774 |
| Семена дыни (ядра) | 755 |
| Какао-порошок | 734 |
| Твёрдый пармезан | 694 |
| Семена подсолнечника (ядра) сушеные | 660 |
| Сафлора семена (ядра) | 644 |
| Семена льна | 642 |
| Семена лотоса | 626 |
| Сыр швейцарский нежирный | 605 |
| Кешью сырые | 593 |
| Орехи пили | 575 |
| Амарантовая крупа | 557 |
| Сыр гауда | 546 |
| Овёс | 523 |
| Грецкий орех чёрный | 513 |
| Печень говяжья тушеная | 497 |
| Фисташки сырые | 490 |
| Миндаль | 481 |
| Киноа | 457 |
| Люпин, семена | 440 |
| Карп | 415 |
| Фасоль | 407 |
| Арахис | 397 |
| Сыр рокфор | 392 |
| Мука из цельного зерна | 357 |
| Печень куриная | 297 |
| Вырезка свиная | 286 |
| Желтоперый тунец | 278 |
| Сгущенное молоко | 253 |
| Яйцо | 198 |
| Говядина | 188[16] |
| Курица | 178 |
